- INÍCIO
- CINÉTICA QUÍMICA E EXERCÍCIOS RESOLVIDOS
- CÁLCULO ESTEQUIOMÉTRICO
- LINKS SOBRE QUIMICA AMBIENTAL E OUTROS TÓPICOS
- EXERCÍCIOS DE TERMOQUÍMICA
- ISOMERIA E MEDICAMENTOS
- RADIOQUÍMICA EXERCÍCIOS RESOLVIDOS
- PROPRIEDADES DA MATÉRIA
- QUÍMICA ORGÂNICA
- TOXINA DESCOBERTA CAUSA MEDO EM PESQUISADORES....
- SITES DAS UNIVERSIDADES, SEU FUTURO...
- TESTE VOCACIONAL
- LITERATURA INFANTO JUVENIL
- FOTOS DOS MEUS ALUNOS ( ENVIE SUAS FOTOS)
- DEIXAR PERGUNTA?
- Contactos
EXERCÍCIOS DE TERMOQUÍMICA
Exercícios sobre termoquímica
Leia o artigo: Termoquímica ( OBSERVAÇÃO : ENTENDA D COMO DELTA POR EXEMPLO DH = VARIAÇÃO DE ENTALPIA)
Questões:
01. (OSEC) Analise as afirmativas abaixo:
I. Entalpia (H) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta D H positivo.
III. O calor de reação de um processo químico será dado por D H.
a) somente I é correta
b) somente II é correta
c) somente III é correta
d) as afirmativas I e II são corretas
e) as afirmativas I e III são corretas.
02. Pode uma transformação apresentar diminuição de entalpia e diminuição de entropia ser espontânea?
03. (OSEC) Considerando-se a transformação isotérmica N2O(g) ® N2(g) + O2(g) à 25°C e sabendo-se que a variação de entalpia (DH) é –19,5 kcal/mol e que a variação de entropia (DS) é 18 cal/grau . mol, podemos afirmar que a variação de energia livre (DG) do sistema é:
a) +19,25 kcal e espontâneo
b) –19,25 kcal e não espontâneo
c) +24,86 kcal e não espontâneo
d) –24,86 kcal e espontâneo
e) n.d.a.
04. (FEI) Determinar a espontaneidade da reação C2H2 + 2H2 ® C2H6 à temperatura de 100°C. 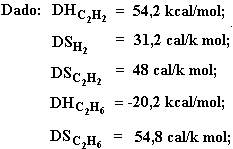
05. (FEI) Para uma dada reação sabe-se que DH = 20 kcal/mol e DS = 80 cal/mol . k. Qual o DG dessa reação a 1 000 K?
06. (BRASÍLIA) A energia de ligação média para a ligação C – H no metano CH4(g) é aproximadamente:
Dado: DHf0 (entalpia de formação-padrão)
CH4(g) = -17,9 kcal/mol
H(g) = +52,1 kcal/mol
C(g) = +170,9 kcal/mol
a) +99 kcal/mol
b) +60 kcal/mol
c) +73 kcal/mol
d) +397 kcal/mol
07. (PUC) Considerando a reação dada pela equação H2(g) + I2(g) e sabendo que as entropias-padrão, nas condições da reação são:
- para o H2(g): 31,2 cal/K . mol
- para o I2(g): 27,9 cal/K . mol
- para o HI(g): 49,3 cal/K . mol
Podemos concluir que a variação de entropia na reação dada, por mol de HI formado, em cal/K . mol, é igual a:
a) –4,9
b) –9,8
c) +19,7
d) +39,5
e) +108,4
08. (FEI) Por que motivo, às altas temperaturas, as reações químicas tendem a ser espontâneas?
09. (PUC – MG) Os DGf 0 da glicose e etanol em solução aquosa são –219,20 e –43,40 Kcal/mol, respectivamente, e o DGf 0 do dióxido de carbono gasoso é –94,30 Kcal/mol. A 25°C, o DG 0 em Kcal/mol da reação: Glicose ® 2 etanol + 2 CO2 é:
a) 494,60
b) –81,50
c) 81,50
d) –56,20
e) 56,20
DGf 0 = energia livre de formação
= energia livre padrão = energia livre normal
Resolução:
| 01. E |
02. Sim |
03. D |
04. DG = -53.700 cal e a reação é espontânea.
05. DG = -60 Kcal/mol
06. A
07. C
08. A espontaneidade de uma transformação está relacionada com a variação de entalpia e energia de organização (TDS) que dão valor da variação de energia livre (DG).
DG = DH – T DS À altas temperaturas a entropia (S) dos sistemas aumenta bastante, e, o valor de TD S adquire valor alto e positivo dando D G negativo. Devemos lembrar também que altas temperaturas aumentam a Energia Cinética das moléculas, favorecendo a espontaneidade.
09. D















